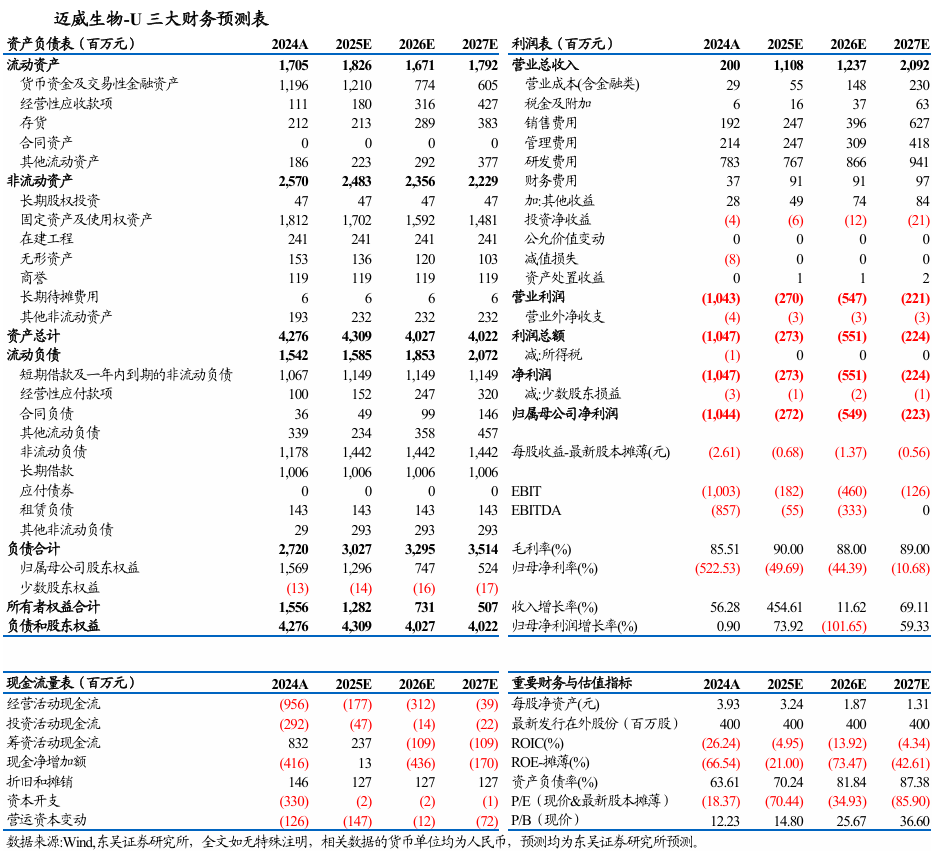
投资要点
投资要点
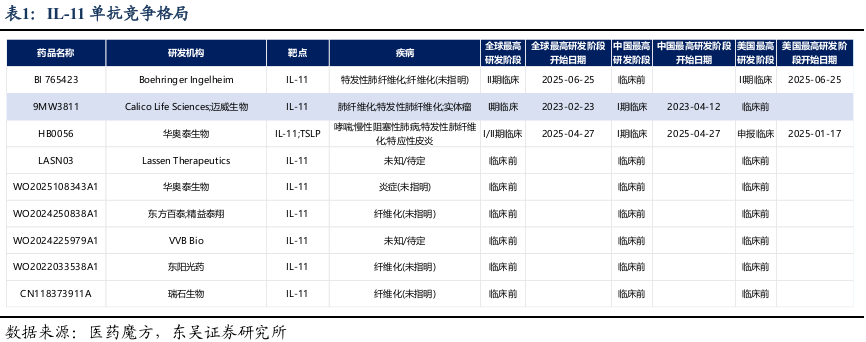
9MW3811为迈威生物自主研发的 IL-11 单抗,全球进展领先且获硅谷巨头布局:9MW3811通过高亲和力结合 IL-11,阻断 IL-11/IL-11Ra 下游信号通路,干预相关病理进程,聚焦抗纤维化与抗衰老领域未满足需求。其临床进度国内第一、全球前二,已获中美澳三国临床准入,中国及澳洲 I 期临床已完成且安全性良好。2025 年 6 月,迈威将该产品除大中华区外全球开发及商业化权利独家许可 Calico Life Sciences(由Alphabet及谷歌母公司旗下的抗衰老子公司,和Abbvie深度合作),获 2500 万美元一次性不可退还首付款、最高 5.71 亿美元里程碑付款及阶梯式特许权使用费。
9MW3811抗衰老机制明确,后续有望拓展病理性瘢痕适应症: 9MW3811(IL-11 单抗)的抗衰逻辑清晰且扎实,它通过精准靶向抑制 IL-11 信号,可直接阻断其下游 ERK-mTORC1、JAK-STAT3 等促衰老通路的异常激活,进而减少 p16/p21 等关键衰老标志物的表达,从分子层面改善代谢功能衰退、慢性炎症等核心衰老相关病理表现;在适应症拓展方面,9MW3811 同步瞄准临床需求迫切且市场空间广阔(美国 2030 年预计 186 亿美元,中国 59 亿美元)的病理性瘢痕领域,上海九院研究证实“CD39 +成纤维细胞- IL-11 轴”是病理性瘢痕形成核心通路,该产品已申报 II 期临床,有望年底前启动入组,临床周期短,可快速获取人体 POC 数据;针对 IL-11 介导的肺成纤维细胞活化、胶原异常沉积等核心病理环节,MW3811也能从源头抑制肺纤维化进展,精准契合该领域未被满足的治疗需求。
多款重磅管线厚积薄发:1)9MW1911:国内进度最快、全球第二的 ST2 单抗COPD 患者的 Ib/IIa 期 80 例患者已全部入组,预计 2025 年 H2 完成随访,力争年底前后读出有效性数据;2)9MW2821:全球进度领先、具 BIC 潜力的 Nectin-4 ADC,临床数据优异——1.25mg/kg 推荐剂量下,对尿路上皮癌、宫颈癌、食管癌、三阴性乳腺癌的疾病控制率分别达 91.9%、81.1%、67.4%、80%,多个肿瘤适应症 III 期临床推进中,最早 2026 年有望提交 BLA;3)7MW4911 与 7MW3711:基于 IDDC 平台的 ADC 药物,分别靶向 CDH17 与 B7-H3,采用毒素升级的新结构喜树碱衍生物,具备抗毒素耐药疗效,更好满足临床需求;4)TCE 平台管线:自主搭建 TCE 平台,2MW7061(CD3; LILRB4)为公司首款预计进入临床的 TCE 药物,适应症为 AML。
盈利预测与投资评级:我们维持2025-2027年的营收预测,分别为11.08/12.37/20.92亿元。上述预测不含未落地BD付款,维持“买入”评级。
风险提示:研发进度不及预期的风险;药品审批和上市时间不及预期的风险;竞争格局加剧的风险。


1. 9MW3811:直击纤维化与抗衰老相关的临床为满足刚需
9MW3811 是迈威生物自主研发的IL-11单抗,潜在FIC产品。该IL-11单抗通过亲和力结合IL-11,有效阻断IL-11/IL-11Ra介导的下游信号通路,从而干预相关信号通路异常激活导致的病理进程。9MW3811临床研发进度为国内第一,全球前二,目前已获中美澳三个国家的临床准入,其中中国和澳洲临床I期已经完成,安全性良好。基于优异的临床前和临床数据,迈威于25年6月将9MW3811在除大中华区以外所有区域的开发及商业化权利独家许可给Calico Life Sciences,获得一次性不可退还首付款2,500万美元、合计最高达5.71亿美元的里程碑付款,以及阶梯式特许权使用费。
1.1. IL-11 机制清晰,成药逻辑闭环
IL-11是慢性炎症和纤维化相关疾病的关键细胞因子,也被认为是衰老相关疾病的重要因子。阻断IL-11对包括器官纤维化、肿瘤和衰老导致的代谢衰退、多种疾病并发和身体虚弱等具有潜在的临床应用价值。
IL-11 作为 IL-6 家族成员,具有促炎、促纤维化特性,可激活 ERK-mTORC1、JAK-STAT3 通路,导致纤维化同时与衰老标志物“细胞衰老”相关。从促纤维化作用来看,在衰老相关的组织病理进程中,IL-11 是推动纤维化发生发展的关键分子。其通过激活 JAK-STAT3 通路,直接促进成纤维细胞活化并向肌成纤维细胞转化——这一过程是组织纤维化的核心环节,活化后的肌成纤维细胞会大量合成并分泌胶原纤维(如 I 型胶原),同时 IL-11 还能上调胶原合成相关基因(如 Col1a1)的表达,最终导致胶原在组织内异常沉积,加重纤维化程度。此外,IL-11 激活的 ERK-mTORC1 通路可增强成纤维细胞的代谢活性,为胶原合成提供充足的物质和能量基础,进一步放大促纤维化效应。
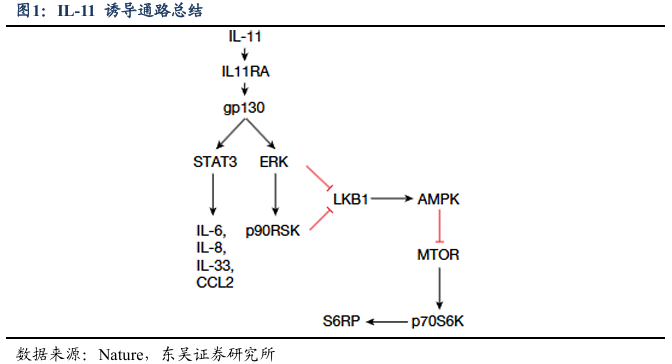
从与细胞衰老的关联来看,IL-11 可通过调控关键ERK-AMPK-mTORC1 信号轴推动细胞衰老进程,并与衰老标志物紧密相关。随哺乳动物年龄增长,IL-11 在肝脏、vWAT、骨骼肌等多组织中渐进性上调,其上调后会激活 ERK-p90RSK 信号,同时抑制 LKB1-AMPK 信号——其中 AMPK 是维持细胞代谢稳态的关键激酶,其活性被抑制会导致细胞代谢功能衰退;这一系列信号变化会进一步激活 mTOR-p70S6K-S6RP 通路,而 mTORC1 过度激活是细胞衰老加速的核心因素,最终促使细胞周期停滞,导致衰老标志物 p16(p16Ink4a)和 p21(p21Waf1/Cip1)的表达水平显著升高。同时,IL-11 还能调控 JAK-STAT3、NF-κB 等促炎信号通路,加剧慢性无菌炎症——这是衰老的核心特征之一,而慢性炎症又会进一步诱导 IL-11 表达,形成“炎症-衰老- IL-11 上调”的恶性循环,使细胞衰老和组织功能衰退不断加重。
1.2. IL-11 单抗抗衰老机制明确,临床攻坚破局即立壁垒
当前人类对抗衰老的探索,整体仍较多停留在概念验证阶段,尚未形成成熟的临床转化体系,而二甲双胍是目前唯一经 FDA 获批抗衰老适应症的药物。从二甲双胍的 TAME(Targeting Ageing with Metaformin)试验来看,其设计思路与 FDA 批准药物的传统试验模式存在显著差异:传统试验通常以单一疾病作为核心终点,而该试验则创新性地设置了复合主要终点,具体涵盖中风、心力衰竭、痴呆、心肌梗死、癌症及死亡六大关键健康事件,以此更全面地评估药物在延缓衰老相关健康风险中的作用。

在抗衰老研究的动物试验层面,抗 IL-11 单抗展现出显著的抗衰潜力:不仅能改善衰老小鼠的代谢与肌肉功能、减少老化生物标志物及身体虚弱状态,更能延长小鼠寿命——其中雄性小鼠中位寿命延长 22.5%,雌性小鼠延长 25%。该试验设计具有明确的靶向性与规范性:实验对象选取 75 周龄(相当于人类 55 岁)的雌雄小鼠,试验周期持续 25 周(直至小鼠 100 周龄),期间每 3 周为小鼠腹腔注射 40mg/kg 的 IL-11 单抗药物(对照组注射 IgG),最终多项关键健康指标呈现明显改善。具体来看,试验结果集中体现在四大核心维度:
代谢功能优化:用药组小鼠脂肪量显著减少、瘦体重相应增加;葡萄糖耐量试验(GTT)与胰岛素耐量试验(ITT)结果改善,提示血糖调节能力提升;呼吸交换比(RER)升高,意味着小鼠代谢灵活性增强(详见图 b、c、d、g)。
肌肉功能提升:100 周龄时,用药组小鼠的全身握力不仅高于同期 IgG 对照组,还超越了 75 周龄时的基线水平,表明肌肉力量随年龄增长的衰退趋势得到有效遏制(详见图 f)。
组织保护强化:小鼠肝脏甘油含量降低,肝损伤标志物丙氨酸氨基转移酶(ALT)水平下降,同时内脏白色脂肪组织(vWAT)、肝脏及骨骼肌的纤维化程度均减少,组织健康状态得到改善(详见图 h、i、j、k)。
衰老信号抑制:内脏白色脂肪组织(vWAT)中 ERK-mTORC1 信号通路的异常激活受到抑制,衰老相关标志物 p16 与 p21 的表达水平降低,且端粒长度与线粒体 DNA(mtDNA)拷贝数得以较好保留,延缓了细胞层面的衰老进程(详见图 m)。

目前全球进入临床的IL-11单抗仅三家,其中BI的BI 765423进度最快,于25年6月进入治疗肺纤维化的2期临床阶段,迈威生物紧随其后,1期中澳临床已顺利结束,结果显示药物安全性良好,预计25年年内启动2期临床。
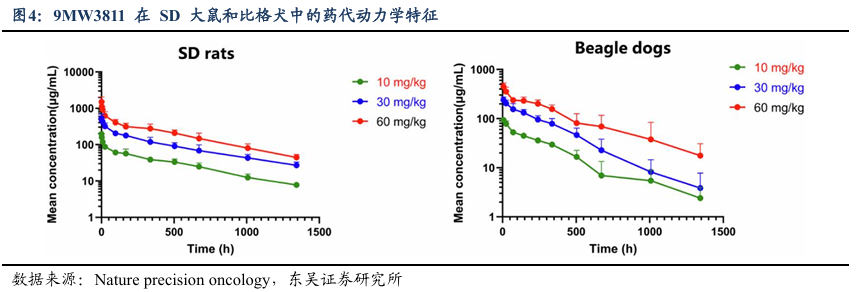
9MW3811 在临床前研究中展现出良好的安全性与突出的药物优势,还在与同类药物的对比中体现出差异化价值。在临床前毒性试验设计上,研究人员分别对 SD 大鼠(设 30、100、300mg/kg 三个剂量组)和比格犬(同设 30、100、300mg/kg 三个剂量组)采用每周静脉给药、持续 3-5 次的方案,观察药物毒性反应:其中 SD 大鼠各剂量组均耐受良好,无观察到有害作用水平(NOAEL)达 300mg/kg;比格犬 300mg/kg 组仅出现轻微贫血(红细胞、血红蛋白降低)及淋巴结淋巴细胞计数变化,NOAEL 为 100mg/kg,最高非严重毒性剂量(HNSTD)为 300mg/kg,整体毒性反应轻微且可逆。
在优势对比层面,相较于 TGF-β抑制剂,IL-11 的表达更局限于病理状态,靶向 IL-11 的 9MW3811 可有效避免 TGF-β抑制剂可能引发的心血管毒性,药物特异性更高;相较于其他 IL-11 靶向药物(如 IL-11 突变蛋白),9MW3811 作为单克隆抗体,具有更长的半衰期(大鼠体内半衰期 400-430h,犬体内半衰期 150-248h),能显著提升临床给药的便捷性。
依托扎实的临床前数据与临床阶段初步人体数据支撑,迈威生物于 2025 年 6 月达成重要合作——将 9MW3811 除大中华区以外所有区域的开发及商业化权利,独家许可给 Calico Life Sciences。根据合作协议,迈威生物将获得 2500 万美元一次性不可退还首付款、合计最高达 5.71 亿美元的里程碑付款,以及阶梯式特许权使用费。
此次授权的合作方 Calico Life Sciences 绝非普通初创生物公司,其行业地位与资源实力决定了此次合作的意义远超出账面约 6 亿美元的授权价值,甚至比与传统跨国药企(MNC)合作更具行业标志性。从背景来看,Calico 由谷歌的创始人Page于 2013 年发起成立,全球制药巨头 AbbVie 是其早期重要投资方与核心合作伙伴;从团队配置来看,公司管理层实力堪称行业顶尖—— CEO由 Genentech 前 CEO Arthur Levinson(1995-2009 年任职期间,一手推动 Genentech 发展壮大)担任,首席科学官(CSO)为美国国立卫生研究院(NIH)免疫系统实验室分子发展科首席研究员、美国国家科学院院士、美国国家医学院院士Michael Lenardo教授。
Calico 当前管线布局高度聚焦且精简,仅包含 4 条核心管线:迈威生物的 IL-11 单抗(9MW3811)、针对渐冻症(ALS)的 Fosi 疗法、基于 AI 平台开发的表观遗传重编程机制抗衰药物,以及与 AbbVie 合作开发的另一款 ALS 疗法。在这 4 条管线中,9MW3811 不仅是核心组成部分,更是目前进展最快、落地前景最明确的管线,后续有望迅速启动二期临床试验,进一步推进研发进程。
1.3. 9MW3811 治疗病理性瘢痕,全球首款,市场空间大
病理性瘢痕主要包括增生性瘢痕、瘢痕疙瘩、挛缩瘢痕等,尚无标准疗法。增生性瘢痕(HTS)指疤痕肿胀、浮肿及变红,使疤痕从周围皮肤中凸起,通常由烧伤、外伤及外科手术引起。瘢痕疙瘩指当疤痕组织不规则生长或比伤口愈合更快时形成的凸起胶原蛋白块。瘢痕疙瘩通常由痤疮、烧伤、外伤及外科手术引起。增生性瘢痕及瘢痕疙瘩为每年影响美国及中国超过1600万患者的常见皮肤病,可导致永久性功能丧失和毁容的心结。增生性瘢痕/瘢痕疙瘩目前并无标准治疗方法,可用的治疗选择为病灶内注射、冷冻疗法、博莱霉素、激光疗法及手术切除。
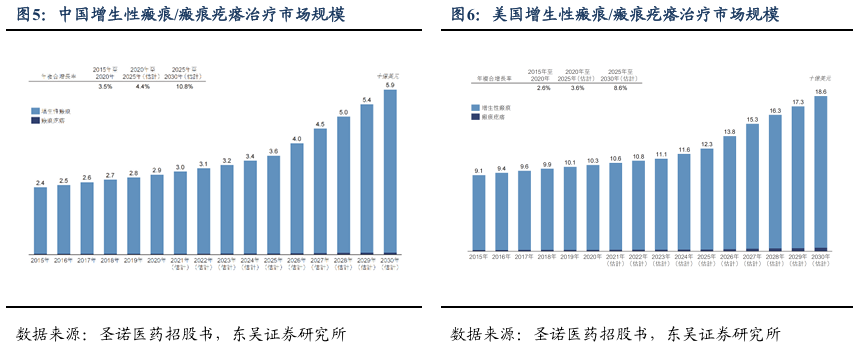
增生性瘢痕/瘢痕疙瘩治疗市场规模市场潜力大。根据圣诺医药招股书数据,美国增生性瘢痕及瘢痕疙瘩治疗的综合市场规模预计在未来数年增长加快,自2020年的103亿美元增长至2025年的123亿美元并进一步增长至2030年的186亿美元,2020年至2025年的年复合增长率为3.6%,2025年至2030年的年复合增长率为8.6%。预计中国HTS及瘢痕疙瘩治疗的市场规模亦将加快增长,自2020年的29亿美元增长至2025年的36亿美元并进一步增长2030年的59亿美元,2020年至2025年的年复合增长率为4.4%,2025年至2030年的年复合增长率为10.8%。
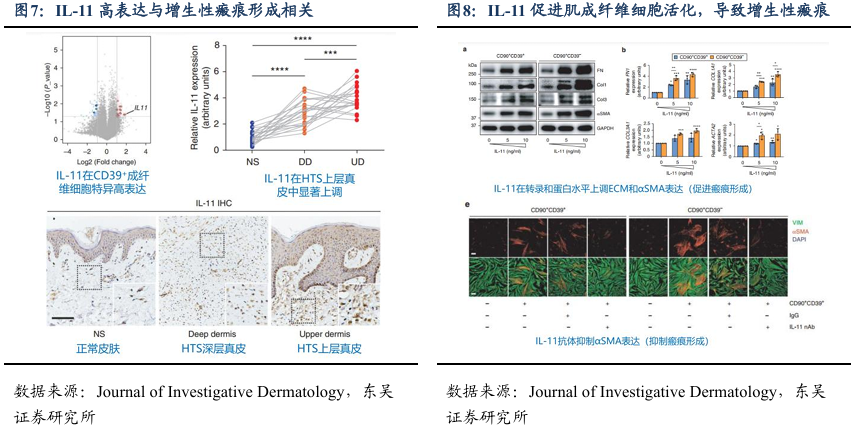
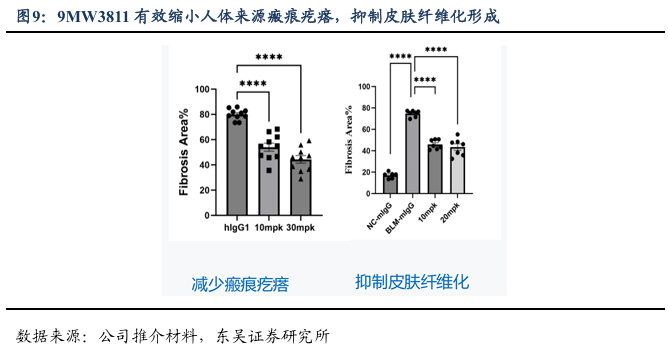
上海九院李青峰团队发现IL-11是治疗瘢痕的潜力靶点,迈威生物9MW3811能有效缩小人体来源瘢痕疙瘩。2021 年,上海第九人民医院整复外科主任李青峰教授团队在国际权威期刊《Journal of Investigative Dermatology》发表重要研究成果。该研究首次明确:CD39 +成纤维细胞是增生性瘢痕形成的核心效应细胞,其分泌的细胞因子 IL-11表达水平与瘢痕严重程度呈显著正相关;更关键的是,IL-11 是该细胞亚群中上调幅度最大的细胞因子,相较于正常组织,其表达量提升了 5-8 倍。这项研究的核心突破在于,首次证实 IL-11 信号通路在瘢痕增生中发挥关键调控作用,揭示“CD39 +成纤维细胞- IL-11 轴”在病理性瘢痕(如增生性瘢痕)形成中的核心驱动地位,为“靶向 IL-11 的瘢痕治疗”提供了直接且坚实的理论依据。基于上述重要发现,李青峰教授团队目前正推进相关转化医学研究,重点验证 IL-11 靶向药物在瘢痕临床治疗中的实际效果。这一探索不仅为瘢痕治疗领域提供了新的技术路径,更直接为 9MW3811 等 IL-11 抑制剂在整形修复领域的应用,开辟了极具潜力的新方向。
9MW3811已申报 II 期临床,并于25年8月获得国家药品监督管理局(NMPA)正式受理,有望年底前启动入组,临床周期短,可快速获取人体 POC 数据,我们期待其在病理性瘢痕适应症上的进一步进展。
2. 多款重磅管线厚积薄发
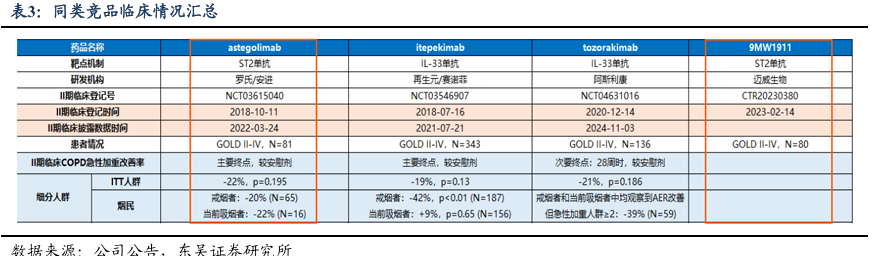
2.1. 9MW1911(ST2),自免领域/COPD创新疗法,展现初步有效性结果
慢性阻塞性肺病(COPD)市场需求大。慢性阻塞性肺疾病已成为与高血压、糖尿病“等量看齐”的慢性疾病、全球第三大疾病死因,全球患病率为10.3%,1)据“中国肺健康研究”调查数据显示,目前我国40岁以上人群慢阻肺患病率已上升至13.7%;2)2022年5月《柳叶刀》文章显示,中国慢阻肺患者人数已达1.058亿,患病率高达12%。2024年全球患病人数将达到5.3亿;3)根据PrecedenceResearch报告显示,据估计,2032年COPD市场规模或将达到600亿美元,其中中国市场也将超过300亿元。
现有疗法具有局限性,急需探索替代治疗策略。当前COPD治疗药物主要有LABA(长效β2受体激动剂)、LAMA(长效抗胆碱能抑制剂)、ICS(吸入性糖皮质激素)、PDE3/4抑制剂(2024年6月获FDA批准),且需要考虑EOS计数(血嗜酸性粒细胞)。据Verona披露的调查数据,约50%患者对三联维持治疗感到不满意。吸入制剂在预防COPD急性加重方面具有局限性(支气管扩张和抗炎、改善呼吸功能、时有症状控制不佳、副作用大等)。
9MW1911注射液是一款由迈威生物自主研发的创新型人源化单克隆抗体药物,其抗体分子基于B淋巴细胞筛选平台获得,具有亲和力高,生物活性强的特点。非临床研究显示该品种动物体内作用机制清晰明确,与ST2特异性结合后,能够阻断细胞因子IL-33对ST2介导的信号通路的激活,抑制炎症反应的发生,从而实现对多种自身免疫性疾病的治疗。
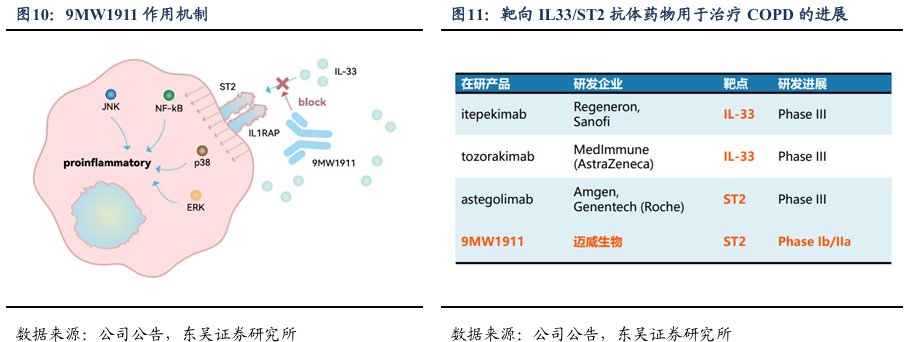
9MW1911有望带来更大患者获益,未来增加和小分子联用机会。9MW1911是国内首个应用于人体临床研究的抗ST2单抗,在COPD患者中初步体现了疗效,目前正快速推进临床II期研究。临床前研究表明9MW1911在分子水平上,表现出与ST2具有高亲和力,且另有研发发现,多个疾病如心衰、肾病等,可溶性ST2累积可作为疾病标志物,为9MW1911未来开发其他适应症提供了科学依据及可能,同时亦体现靶向ST2的抗体相较于靶向IL33抗体独特优异之处。
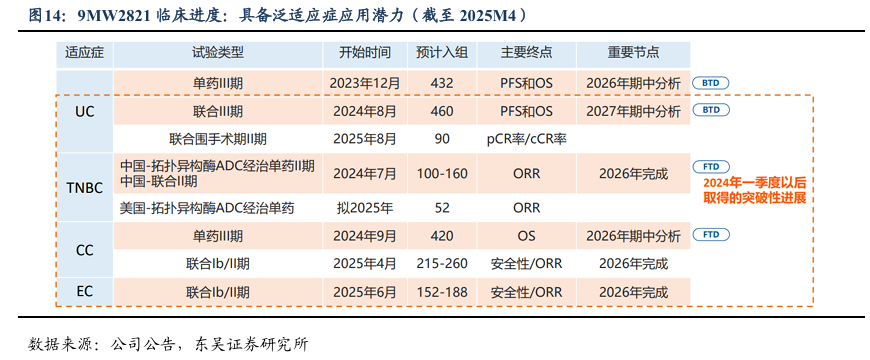
2.2. 9MW2821:进度全球领先、具备泛适应症应用潜力的Nectin-4 ADC
9MW2821是迈威生物基于新一代定点偶联技术平台(IDDC?平台)自主研发的靶向Nectin-4ADC创新药,是国内同靶点药物中首个开展临床试验的品种,也是全球同靶点药物中首个在宫颈癌、食管癌以及乳腺癌适应症披露临床有效性数据的品种,已布局多项ADC+免疫治疗。尿路上皮癌适应症单药、联合PD-1单抗治疗均已进入III期临床,为国内企业首个、全球第二,并获CDE纳入突破性治疗品种名单;宫颈癌适应症为全球同靶点药物中首个进入III期临床的品种。该品种已获FDA多项快速通道认定(包括局部晚期或转移性Nectin-4阳性三阴性乳腺癌)和孤儿药认定。
尿路上皮癌(UC)是世界范围内常见的恶性肿瘤。2024年发布的全球癌症统计报告中显示,膀胱癌是全球第九大常见诊断的癌症,每年有新发病例约61.4万,死亡病例约22.0万。男性疾病负担和发病率显著高于女性,膀胱癌是男性第六大常见癌症,是男性癌症死亡第九大原因。
三阴性乳腺癌约占全球所有乳癌病例的15%至20%,由于缺乏特定的治疗靶点,通常被认为是恶性程度最高的一种亚型。其全球发病数量从2019年的320,100例增至2023年的361,200例,预计2032年将进一步增至479,400例。在中国,三阴性乳腺癌的发病数量从2019年的49,500例增至2023年的54,800例,预计2032年将进一步增至65,400例。

9MW2821由人源化抗Nectin-4抗体和细胞毒载荷单甲基奥瑞他汀E(MMAE)通过二硫键偶联组成,药物抗体比(DAR)为4。在9MW2821进入人体后,可通过人源化抗Nectin-4抗体特异性识别并结合肿瘤细胞表面过表达的Nectin-4蛋白,结合后形成的ADC-Nectin-4复合物被内吞进入肿瘤细胞,随后溶酶将连接子酶解并释放MMAE。MMAE靶向结合细胞内微管蛋白,抑制微管聚合,阻断细胞有丝分裂,最终诱导肿瘤细胞凋亡。
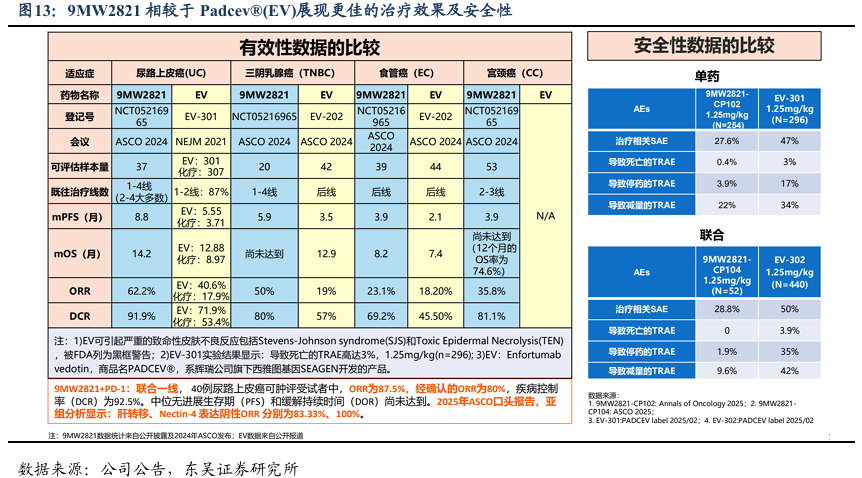
临床数据显示,9MW2821相较于Padcev?(EV)展现更佳的治疗效果及安全性。2025年8月,复旦大学附属肿瘤医院张剑教授等于《肿瘤学年鉴》发表了靶9MW2821在晚期实体瘤患者应用的开放标签、多中心、Ⅰ/Ⅱ期研究成果。该研究确定了1.25mg/kg为II期推荐剂量(RP2D),证实了9MW2821在多种实体瘤中耐受性良好且临床疗效显著。在该剂量下,尿路上皮癌(UC)、宫颈癌(CC)、食管癌(EC)和三阴性乳腺癌(TNBC)的疾病控制率(DCR)分别为91.9%、81.1%、67.4%、80%,为晚期实体瘤治疗提供全新的方向。
2.3. 7MW4911 与7MW3711:基于升级后ADC平台开发
7MW4911和7MW3711是迈威生物基于其自主知识产权的IDDC抗体偶联技术平台开发的创新ADC管线。IDDC技术平台在原有定点偶联和二硫键工艺的基础上,升级了更高效的药物释放结构,辅以新型毒素已达成更强的疗效。两个管线均搭载了新型拓扑异构酶抑制剂,为新结构喜树碱衍生物。

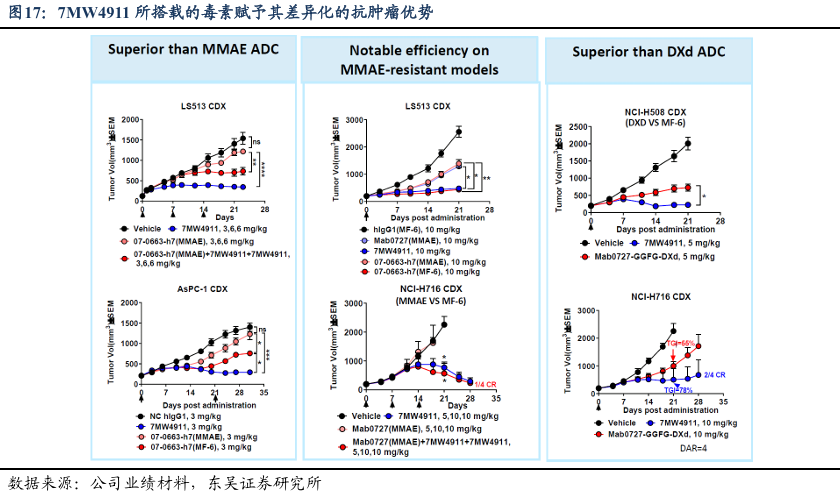
7MW4911是一款CDH17靶向的ADC。CDH17是目前较火热的抗肿瘤研究靶点,其在胃肠道癌症中表达率较高,尤其是在肠癌中阳性率很高,是治疗胃肠道肿瘤的潜在理想ADC靶点。7MW4911采用高度工程化的设计,整合三大核心元件:具有快速内化特性及跨物种(人/猴)中等亲和力的CDH17高特异性单抗Mab0727、新型可裂解连接子、以及为克服多药耐药机制设计的专有DNA拓扑异构酶I抑制剂MF-6载荷。其中,MF-6通过卓越的血浆稳定性、可控的药物释放及强效旁观者效应,显著增强抗肿瘤活性。
该管线具有多种核心优势。在分子设计方面,载药更加均质化,DAR=4的比例大于95%,配合稳定连接子赋予优异血浆稳定性,使得高膜渗透性MF-6毒素产生强效旁观者杀伤。抗肿瘤活性方面,在结直肠癌、胃癌及胰腺癌 PDX/CDX 模型中均展现深度抑瘤效应,且对RAS/BRAF等多种突变及不同CMS分型结直肠癌有效。安全性方面,小鼠研究显示有限组织分布及食蟹猴毒理研究显示可控代谢特征(适中半衰期、无蓄积倾向)和宽治疗窗口,未观察到显著毒性信号。

新款毒素让7MW4911拥有了差异化的抗肿瘤优势。对于其他毒素耐药方面,7MW4911在ABC转运蛋白介导的多药耐药模型中疗效显著优于MMAE/DXd类ADC,并能逆转此类ADC治疗后的肿瘤进展靶标。在不同的癌种模型中,MF-6都展现出优于MMAE和DXd类毒素的优势,在更低剂量下就实现了更优且持久的肿瘤抑制效果,肿瘤体积控制较好。而对于MMAE耐药的模型,MF-6的效果同样显著,其作用机制的差异让其拥有解决临床上毒素耐药的需求。2025年8月18日,公司宣布7MW4911的IND申请已获得FDA批准,将开展用于晚期结直肠癌及其他晚期胃肠道肿瘤安全性、药代动力学和疗效的 I/II 期研究。而国内IND此前已经提交NMPA并获得受理,我们预计其未来将很快获批并开展临床。
7MW3711是公司开发的一款靶向B7-H3的ADC。B7-H3同样是近几年ADC研发领域的热门靶点,其在非小细胞肺癌、胰腺癌、原发性肝癌等多种肿瘤组织中都存在过度表达。在2025年ASCO大会上,公司公布了该管线的I/II 期临床研究数据,在针对晚期实体瘤患者的研究中,4.5mg/kg 或以上剂量组(每 3 周给药 1 次)可肿评患者中,6 例食管癌(EC)、5 例卵巢癌(OC)和 4 例前列腺癌(CRPC)ORR 分别为 33.3%、60.0%和 50.0%,DCR 均为 100%。针对肺癌患者的研究中,4.5mg/kg 剂量组(每 3 周给药 1 次)可肿评的 8 例小细胞肺癌患者的 ORR 和 DCR 分别为 62.5%和 100.0%,4.5mg/kg 或以上剂量可肿评的 8 例 B7-H3 H-score>5的肺鳞癌(Sq-NSCLC)患者 ORR 和 DCR 分别为 37.5%和 87.5%。数据结果提示,7MW3711 在肺癌、食管癌、前列腺癌、卵巢癌等晚期肿瘤患者中具有可耐受的安全性和良好的抗肿瘤活性。我们预计该管线的I/II其临床将在2026年H1完成。
2.4. 一体化TCE创新平台,差异化管线BD可期
公司基于已有的抗体优势开发创新TCE平台,用于双特异性及三特异性抗体的开发。近年来,TCE疗法在肿瘤治疗领域掀起了热潮,通过同时结合T细胞表面的CD3分子与肿瘤细胞表面的特异性抗原,TCE类药物能够高效、精准地激活T细胞并杀伤肿瘤细胞。

该平台支持广泛的双特异性和三特异性形式,可精确靶向不同表达水平的肿瘤抗原,确保靶蛋白的特异性和有效性。该平台的一个显著特点是其差异化设计策略,可根据每个候选药物的独特结构和功能要求进行抗体开发。这种方法显著简化了从临床前研究到商业化规模生产的整个抗体生命周期中的工艺开发和质量控制阶段。通过利用这种以设计为导向的方法,该平台可有效应对各种关键挑战,如提高抗体稳定性、优化表达量和简化整个生产流程。
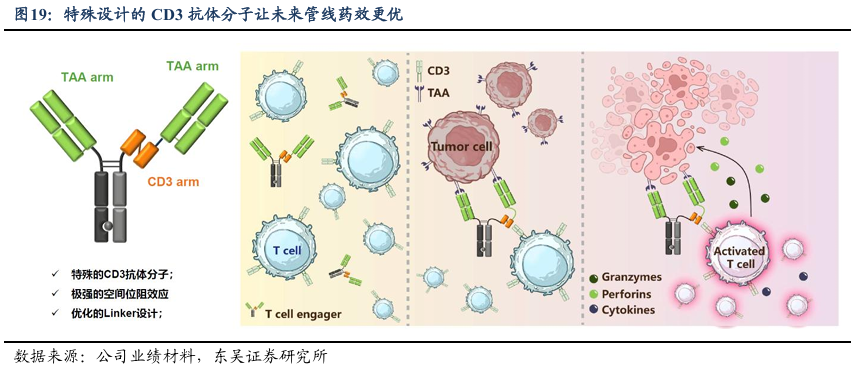
2MW7061是基于迈威生物TCE平台开发的靶向LILRB4和CD3的TCE药物,能够通过选择性激活T细胞消除LILRB4阳性肿瘤细胞,减少对正常T细胞的非特异性激活,从而显著降低细胞因子释放综合症(CRS)的风险。在急性单核细胞白血病(AML)的临床前研究中,2MW7061展现出强大的抗肿瘤活性。在非人灵长类动物的安全性和耐受性研究中,2MW7061表现出良好的安全性,血清中的细胞因子和C-反应蛋白仅出现轻微且短暂的升高,未见显著毒性。该药物有望为LILRB4阳性AML患者带来新的治疗选择。
3. 盈利预测与投资评级
我们维持2025-2027年的营收预测,分别为11.08/12.37/20.92亿元。上述预测不含未落地BD付款,公司差异化布局IL-11单抗,ADC+TCE双平台潜力较大,维持“买入”评级。
4. 风险提示
(1)研发进度不及预期的风险:迈威生物当前多项核心管线仍处于临床前或临床研究阶段,未来可能因临床试验结果未达终点或资金投入不足等因素,导致研发进度延迟或终止。若关键候选药物未能按计划完成临床试验或获批上市,可能对长期盈利能力及估值产生影响。
(2)药品审批和上市时间不及预期的风险:在审批过程中,CDE、FDA等主管机构有可能会在原申报资料基础上补充新的技术资料,甚至有要求补充新的临床试验,因此评审的不确定性将可能会延后公司相关药品上市时间。
(3)竞争格局加剧的风险:全球生物制药领域技术迭代加速,ADC、双抗等热门赛道竞争日趋激烈。行业内其他药企或Biotech公司可能通过其他技术平台抢占市场的可能,导致公司候选药物的临床优势或商业潜力被削弱。