随着出海进程加快,我国药企也越来越多地参与国际竞争。与此同时,FDA对中国药企的监管力度也在不断增强。
此前美国政府问责办公室披露的一份国会委员会报告显示,疫情结束后,FDA对印度和中国进行了最多的海外检查。
数据显示,2023财年,FDA约58%的药品检查针对的是海外设施,近40%的海外场地位于印度和中国[1]。
据FDA官网不完全统计,2024年上半年,中国企业共收到11封警告信,远超往年同期水平。且从全球范围看,中国企业被实施合规行动的数量比例也明显偏高[2]。
FDA官网显示,仅2025年2月4日,就有两家中国企业和一所知名大学被FDA发出警告信。截至3月15日,今年我国内地已有6家企业及大学收到FDA警告信。
而以海正药业为代表的国内药企以“零缺陷”表现通过FDA检查,则有望为行业树立起合规标杆。
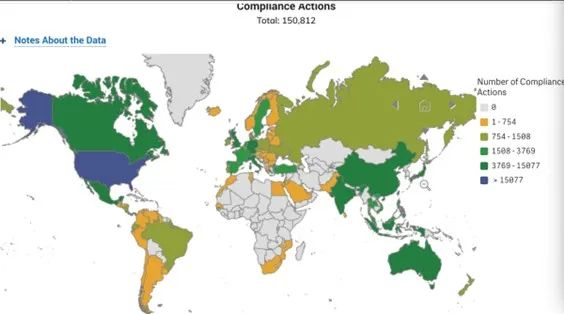
图:FDA在全球范围内合规行动措施统计
海正药业再次“零缺陷”通关
FDA频发警告信,一定程度上增加了出海企业的压力,但也意味着我国药企在合规性上逐渐与国际主流靠拢。这对想要进入美国、欧洲市场的企业而言,显然利大于弊。
连续5次通过FDA检查:市场也传出好消息。3月14日,国内老牌药企海正药业旗下瀚晖工厂以“零缺陷”的优异成绩顺利通过FDA现场审计。
为期5天的审计期间,FDA审计组对瀚晖工厂的生产系统、质量系统、设施与设备、物料系统、包装与标签系统、质量控制等环节进行了全面严格的检查,对其在cGMP标准下实施的全流程管控给予高度评价,认为已达国际一流水平,并最终给出“零缺陷”的结论。
海正药业是一家拥有近70年发展历史的国有制药企业,率先在国内创建QEHS管理体系,对生产全过程进行严格控制和质量检测。据悉,这是瀚晖工厂连续第5次通过FDA检查。
国内最早通过FDA认证:公开资料显示,此次“零缺陷”通过FDA检查之前,海正药业便已经多次获得FDA认证。
最早可以追溯到上世纪90年代,海正药业的妥布霉素和阿霉素分别在1992年和1995年获得FDA认证,成为国内最早通过该认证、成功进入欧美高端市场的企业之一。
近年更是捷报频传:
2024年6月:海正药业(美国)有限公司(HISUN USA)在接受FDA一周的现场审计后,同样以“零缺陷”的表现通过检查;
同年8月:海正药业台州、富阳、南通三大生产基地也均通过了FDA现场检查。
出海是药企的必选项
几乎同一时间,3月13日,天津市医药集团有限公司旗下津药药业发布公告称,公司以VAI(自愿行动指示)的结果顺利通过FDA的cGMP现场检查,这一结果将对公司核心竞争力的提升及持续健康发展产生积极影响。
此前,2022年8月,FDA曾对某国内制药企业的生产场地检查出具警告信。在该公司采取纠正措施后,FDA于近日关闭了警告信。该公司在公告中提到,这将有利于其产品市场的拓展,同时对公司新产品的获批将起到积极的作用,有助于提升经营业绩。
海正药业相关负责人就此表示,品质是医药企业的生命线,公司始终将品质置于首位,以高标准、严执行的态度,全力打造“海正品质”,持续增强在国际市场的竞争力与影响力。
此次FDA审计圆满成功,为公司持续拓展国际市场业务提供了坚实的基础。
尽管面临诸多挑战,但出海仍是众多药企的必选项。Insight数据库显示,2024年中国医药企业海外授权(BD)交易总金额达到635亿美元,创下历年来新高[3]。
近年来,国内药企创新能力不断提升、国际影响力和竞争力不断加强,在全球市场需求增长、国内外政策支持等多因素下,出海既是企业主动拥抱挑战、也是企业下一阶段的生存探索。
FDA监管趋严既是中国药企出海的“压力测试”,也是倒逼行业升级的催化剂。中国药企通过系统性质量体系建设,正逐步缩小与国际标准的差距。出海之路并非坦途,但中国药企终将收获春天。